Trámite orientado para autorizar la importación/exportación de muestras biológicas humanas de sujetos que participan en una investigación biomédica (ensayos clínicos, estudios observacionales).
Ensayo Clínico.- Es cualquier investigación que se realice en seres humanos con intención de descubrir o verificar los efectos clínicos, farmacológicos y/o cualquier otro efecto farmacodinámico de producto(s) en investigación y/o identificar cualquier reacción adversa a producto(s) de investigación y/o para estudiar la absorción, distribución,
metabolismo y excreción de producto(s) en investigación, con el objeto de comprobar su seguridad y/o eficacia.
Estudio observacional en salud: Se entiende por estudio observacional en salud a los estudios epidemiológicos en los que el investigador no manipula las variables de
exposición y se limita a observar, analizar y describir condiciones relacionadas con salud de las poblaciones. En ocasiones en este tipo de estudio es necesaria la toma de muestras biológicas humanas para ser observadas. Se excluyen de esta definición a los ensayos clínicos de cualquier fase (I, II,III y IV). Se incluye en esta definición a los estudios epidemiológicos de intervención en salud, a excepción de aquellos que se consideran ensayos clínicos.
Investigación biomédica: actividad diseñada para desarrollar o contribuir al conocimiento generalizable sobre todos los aspectos médicos y de comportamiento relativos a la salud humana. Estas investigaciones incluyen: (a) estudios de procesos fisiológicos, bioquímicos o patológicos, o de la respuesta a una intervención específica -física, química o psicológica-en pacientes o personas sanas; (b) ensayos controlados de intervenciones diagnósticas, preventivas o terapéuticas en grandes grupos de personas, diseñados para demostrar una respuesta específica generalizable a esas intervenciones contra un fondo de variación biológica individual; (c) estudios diseñados para determinar las consecuencias de intervenciones preventivas o terapéuticas específicas para individuos y comunidades; (d) estudios sobre el comportamiento humano relacionado con la salud en variadas circunstancias y entornos; (e) estudios genéticos; y (f) investigaciones sociales relacionadas con el campo de la salud.
Muestras Biológicas Humanas.- Cantidad limitada de cualquier sustancia o material proveniente de un individuo, pueden ser órganos completos, tejidos, células, ADN, ARN, proteínas o fluidos corporales como orina, saliva, sangre, sudor, humor vítreo, líquido cefalorraquídeo, etc. Este material es utilizado para representar y estudiar enfermedades, genotipos particulares, pruebas de paternidad o ancestria.
El trámite Solicitud de Autorización de importación y exportación de muestras biológicas humanas tiene como beneficiario a toda razón social que cuente con Registro Único de Contribuyentes (RUC), persona natural o jurídica, nacional o extranjera, públicas o privadas.
Dirigido a: Persona Jurídica - Privada, Persona Jurídica - Pública, Persona Natural - Ecuatoriana, Persona Natural - Extranjera.
Autorizacion de importacion exportacion de muestras biologicas humanas
PARA FINES DE INVESTIGACIÓN:
Para solicitar la autorización de importación o exportación de muestras biológicas humanas en ensayos clínicos aprobados por ARCSA, el usuario deberá presentar los siguientes requisitos:
1.- Solicitud para la autorización de importación o exportación de muestras biológicas humanas del ensayo clínico. (Ver Anexo 1).
2.- Autorización de exportación de la muestra o su equivalente otorgado por la autoridad competente del país de origen “de donde proceda la muestra” (solo aplica a las
muestras a importar);
3.- Formulario de importación y exportación de muestras biológicas humanas para ensayos clínicos (Ver Anexo 3).
4.- Copia del contrato o convenio establecido entre el laboratorio que procesará las muestras y el patrocinador / OIC.
5.- Documento donde se especifique las pruebas analíticas a realizarse sobre las muestras obtenidas.
6.- Información de Empresa de Transporte: nacional y/o internacional que realizará el transporte de las muestras biológicas humanas (podrá adjuntar una copia del permiso
de funcionamiento, o certificación de calidad del establecimiento o documento que indique el nombre, dirección y actividad del establecimiento).
Para solicitar la autorización de importación o exportación de muestras biológicas humanas en estudios Observacionales o de Intervención aprobados por un Comité de Ética de Investigación en Seres Humanos (CEISH), el usuario deberá presentar los siguientes requisitos:
1.-Solicitud para la autorización de importación o exportación de muestras biológicas humanas (ver Anexo 2)
2.-Autorización de exportación de las muestras o su equivalente otorgado por la autoridad competente del país de origen " de donde proceda la muestra" ( solo aplica en casos de importación)
3.- Copia de carta de Aprobación del estudio por un Comité de Ética de Investigación en seres humanos aprobado por el Ministerio de Salud Pública.
4.-Formulario de Importación y Exportación de muestras biológicas humanas para estudios observacionales y de intervención (Ver anexo 4)
5.-Copia de contrato o convenio establecido entre el laboratorio que procesará las muestras y el establecimiento donde se realiza el estudio, o el Investigador a cargo del estudio.
6.- Información de la Empresa de Transporte Nacional y/o Internacional que realizará el transporte de las muestras biológicas (podrá adjuntar una copia del permiso de funcionamiento, certificado de calidad del establecimiento o documento que indique el nombre, dirección y actividad del establecimiento).
PARA ATENCIÓN SANITARIA:
Para solicitar la autorización de importación o exportación de muestras biológicas humanas para atención sanitaria, el usuario deberá presentar los siguientes requisitos:
1.-Solicitud para la autorización de importación o exportación de muestras biológicas humanas para atención sanitaria (ver Anexo 5)
2.- Informe Clínico o Certificado médico del paciente suscrito por el médico tratante de Establecimiento de Salud que brinda la asistencia al paciente, con el justificativo médico
donde se indique el diagnóstico y código CIE 10, especificando el estudio a realizar y el motivo del envío / recepción de la muestra biológica humana, en hoja membretada del
establecimiento, con firma de forma manual y sello con nombre, número de registro del Ministerio de Salud Pública / ACESS, número de cédula de identidad, correo electrónico; o, con firma digital, número de registro del Ministerio de Salud Pública / ACESS, número de cédula de identidad, correo electrónico del médico.
3.- Carta de consentimiento informado firmada por el paciente o representante legal, según el caso para la toma de muestra (Ver Anexo 6).
NOTA 4: En el caso de las muestras biológicas que sean tomadas en establecimientos de salud públicos, el profesional tratante deberá llenar el formulario de consentimiento informado para práctica asistencial descrito en el Acuerdo Ministerial 5316.
NOTA 5: Se exceptúan del alcance de este documento la importación y exportación de óvulos, espermatozoides, semen con fines de técnicas de reproducción médica asistida.
NOTA 6: En el caso de que el usuario requiera “Rectificar” una autorización de importación o exportación emitida, deberá enviar un Quipux con la solicitud del cambio (Ver Anexo 5) y adjuntar documentos que justifiquen el cambio cuando aplique.
Certificado de autorización de exportación de la muestra o su equivalente otorgado por la autoridad competente del país de origen “de donde proceda la muestra” debidamente apostillado o consularizado (solo aplica a las muestras a importar).
Procedimiento
Autorización de importación o exportación de muestras biológicas humanas en ensayos clínicos aprobados por ARCSA:
Para obtener la autorización de exportación o importación de muestras biológicas humanas provenientes de ensayos clínicos, el solicitante deberá seguir el siguiente procedimiento:
1. El solicitante debe ingresar la solicitud “Formato de solicitud de autorización de importación o exportación de muestras biológicas humanas para ensayos clínicos” (ver
Anexo 1) a través del Sistema de Gestión Documental-Quipux en las Coordinaciones Zonales o Planta Central de la ARCSA o mediante la plataforma institucional
“plataforma gob.ec” con al menos veinte (20) días plazo previo a realizar la toma de la muestra (con el fin de evitar la pérdida de calidad de las muestras que requieren ser
analizadas de forma inmediata), adjuntando todos los requisitos descritos en el numeral 3.1.1.1.
2. Una vez asignada la solicitud a la Dirección Técnica de ensayos clínicos, se procederá a emitir la orden de pago vía Quipux o mediante la plataforma institucional
“plataforma gob.ec”, para lo cual el solicitante dispondrá de dos (2) días término para cancelar la tasa de importe; posteriormente el solicitante deberá remitir el
comprobante de pago junto con la orden pago al correo: arcsa.facturacion@controlsanitario.gob.ec. La ARCSA remitirá al solicitante vía correo electrónico la factura correspondiente.
3. La Dirección Técnica de Ensayos Clínicos analizará y validará la información proporcionada en el término de diez (10) días contados a partir de la fecha de
recepción de la solicitud siempre y cuando se haya verificado la cancelación del importe.
4. En caso de no estar completa o correcta la información, la Agencia enviará mediante el Sistema documental Quipux o mediante el correo registrado en la plataforma
institucional “plataforma gob.ec”, las observaciones encontradas, relativas a la solicitud y sus anexos;
5. El solicitante deberá subsanar las observaciones en el término de diez (10) días, contados a partir de recibida la notificación, y procederá a enviarlas mediante correo
electrónico o Quipux según corresponda; si la subsanación no está correcta se procederá a emitir por última vez nuevas observaciones, las cuales si no son
subsanadas correctamente en el término de diez (10) días, el trámite será cancelado. Podrá ingresar un nuevo trámite con toda la documentación correcta y completa.
6. En caso de no recibir las subsanaciones en el tiempo solicitado, se dará por concluido el trámite automáticamente y se archivará el proceso, pudiendo ser reaperturado al
presentar nuevamente toda la documentación; la ARCSA comunicará al solicitante la cancelación del trámite a través del correo electrónico registrado en la plataforma
gob.ec o por medio Sistema de Gestión Documental Quipux.
7. Si la información de la solicitud presentada está completa y correcta, y es favorable el análisis técnico documental, se otorgará la Autorización posterior a los diez (10) días
término de su revisión por medio del Sistema de Gestión Documental Quipux. En el caso de los trámites ingresados por la plataforma gob.ec, el interesado podrá
descargar la autorización desde el correo electrónico registrado para el efecto.
NOTA 1: La autorización que se emita para el efecto, será exclusivamente para las muestras biológicas humanas solicitadas.
NOTA 2: En caso de que el número de muestras biológicas humanas al momento de ser exportadas por el solicitante sea diferente al número de muestras biológicas autorizadas, el solicitante deberá solicitar a la ARCSA un alcance a la autorización emitida presentando la justificación respectiva.
NOTA 3: El proceso de solicitud de tramite será conforme el Instructivo de sistemas externo para el registro de solicitud de autorización de importación y exportación de muestras biológicas (ISE-B.3.3.2-01), en plataforma gob.ec o el instructivo vigente aplicable para el efecto.
Autorización de importación o exportación de muestras biológicas humanas en estudios Observacionales o de Intervención aprobados por un Comité de Ética de Investigación en Seres Humanos (CEISH)
Para obtener la autorización de exportación o importación de muestras biológicas humanas para estudios observacionales o de intervención, el solicitante deberá seguir el siguiente procedimiento:
1. El solicitante debe ingresar la solicitud “Formato de solicitud de autorización de importación o exportación de muestras biológicas humanas para estudios observacionales / intervención” (Ver Anexo 2) a través del Sistema de Gestión Documental-Quipux en las Coordinaciones Zonales o Planta Central de la ARCSA o mediante la plataforma institucional “plataforma gob.ec” con al menos veinte (20) días plazo previo a realizar la toma de la muestra (con el fin de evitar la pérdida de calidad de las muestras que requieren ser analizadas de forma inmediata), adjuntando todos los requisitos descritos en el punto 3.1.2.1.
2. Una vez asignada la solicitud a la Dirección Técnica de Ensayos Clínicos, se analizará y validará la información proporcionada en el término de diez (10) días contados a partir de la fecha de recepción de la solicitud.
3. En caso de que la información esté incompleta o incorrecta, se enviarán las observaciones encontradas relativas a la solicitud y sus anexos, mediante el Sistema
documental Quipux o mediante la plataforma institucional “plataforma gob.ec”;
4. El solicitante deberá subsanar las observaciones en el término de diez (10) días contados a partir de recibida la notificación, y procederá a enviarlas por Quipux o correo
electrónico. Si la subsanación no está correcta se procederá a emitir por última vez nuevas observaciones, las cuales, si no son subsanadas correctamente en el término dediez (10) días, el trámite será cancelado. Podrá ingresar un nuevo trámite con toda la documentación correcta y completa.
5. En caso de no recibir la subsanación en el tiempo solicitado, se dará por concluido el trámite automáticamente y se archivará el proceso; pudiendo ser reaperturado
presentando nuevamente toda la documentación. La ARCSA comunicará al solicitante la cancelación del trámite a través del Sistema de Gestión Documental Quipux, o mediante el correo electrónico registrado en la plataforma gob.ec.
6. Si la información presentada está completa y correcta, y es favorable el análisis técnico documental, se otorgará la Autorización mediante el Sistema de Gestión documental
Quipux, posterior a los diez (10) días término de su revisión. En el caso de los trámites ingresados por la plataforma gob.ec, el interesado podrá descargar la autorización
desde el correo electrónico registrado para el efecto.
Autorización de importación o exportación de muestras biológicas humanas para atención sanitaria
Para obtener la autorización de exportación o autorización de importación de muestras biológicas humanas para Atención Sanitaria, el solicitante debe seguir el procedimiento
detallado a continuación:
1. El solicitante debe ingresar la solicitud “Formato de solicitud de autorización de importación o exportación de muestras biológicas humanas para atención sanitaria”
(Ver Anexo 5) a través del Sistema de Gestión Documental-Quipux en las Coordinaciones Zonales o Planta Central de la ARCSA, o mediante la plataforma institucional “plataforma gob.ec”, adjuntando todos los requisitos descritos en el punto 3.2.1. Con el fin de evitar la pérdida de calidad de las muestras que requieren ser analizadas de forma inmediata y que necesiten ser procesadas fuera del país, el usuario debe iniciar el proceso de autorización antes de realizar la toma de las muestras.
2. La ARCSA verificará, analizará la información proporcionada y emitirá respuesta en siete (7) días término, contados a partir de la recepción de la solicitud por la ARCSA o
quien ejerza sus competencias; en caso de no estar completa o correcta la información o de requerir información adicional, la Agencia podrá solicitar la documentación
pertinente al interesado mediante correo institucional (atención.ensayosclinicos@controlsanitario.gob.ec).
3. El solicitante deberá subsanar las observaciones en el término de siete (7) días contados a partir de recibida la notificación, y enviará la información al correo electrónico antes mencionado. Si la subsanación no está correcta se procederá a emitir por última vez nuevas observaciones, las cuales si no son subsanadas correctamente en el término de siete (7) días, el trámite será cancelado. Podrá ingresar un nuevo trámite con toda la documentación correcta y completa.
4. En caso de no obtener respuesta en el término de siete (7) días, contados a partir de recibida la notificación para la corrección de las observaciones relativas a la solicitud y
sus anexos, se dará por concluido el trámite automáticamente y se archivará el proceso. La ARCSA comunicará al interesado la cancelación del trámite a través del correo
electrónico registrado en la plataforma gob.ec o por el Sistema de Gestión Documental - Quipux. Posteriormente, podrá ingresar un nuevo trámite con toda la documentación
correcta y completa.
NOTA 7: En el caso de los trámites ingresados por la plataforma institucional gob.ec (ISEB.3.3.2-01) o el instructivo vigente aplicable para el efecto, el interesado podrá descargar la autorización.
NOTA 8: La Autorización que se emita para el efecto será exclusivamente para la muestra biológica humana solicitada.
Canales de atención: Presencial, Sistema de Gestión Documental Quipux (www.gestiondocumental.gob.ec).
Solicitud de autorización de exportación de muestras biológicas humanas unicamente en ensayos clínicos aprobados por la ARCSA $ 109,71
ARCSA Planta Central (Ciudadela Samanes, Av. Francisco de Orellana y Av. Paseo del Parque, Parque Samanes, Bloque 5, Guayaquil - Ecuador). Código Postal: 090703.
De lunes a viernes 08h00 a 17h00.
9 Coordinaciones Zonales (https://www.controlsanitario.gob.ec/contacto/).
Contacto: Dirección Técnica de Atención al usuario
Email: atencionalusuario@controlsanitario.gob.ec
Teléfono: 043727440
DISPOSICIONES GENERALES:
TERCERA.- En el caso de importación y/o exportación demuestras biológicas con fines de investigación, eL patrocinador deberá solicitar a la ARCSA la autorización
correspondiente, que la emitirá verificando el cumplimiento de las disposiciones constitucionales referentes a la protección de los recursos genéticos. Con el fin de evitar lapérdida de calidad de las muestras que requieren ser analizadas de forma inmediata y que necesiten ser procesadas fuera del país, dicho patrocinador iniciará el proceso de autorización con al menos veinte días plazoantes de realizar la toma de las muestras. La ARCSA deberá responder el requerimiento en un plazo de veinte(20) días, contados a partir de la fecha en que reciba la
solicitud.
Art. 1.- Delegar a la Agencia Nacional de Regulación, Control y Vigilancia Sanitaria - ARCSA, “Doctor Leopoldo Izquieta Pérez”, para que autorice procesos de importación
y exportación de muestras biológicas, a ser utilizadas por investigadores de salud en el desarrollo de sus estudios.Exceptuase de esta disposición aquellas muestras biológicas
reguladas por la Ley Orgánica de Donación y Trasplante de Órganos, Tejidos y Células.
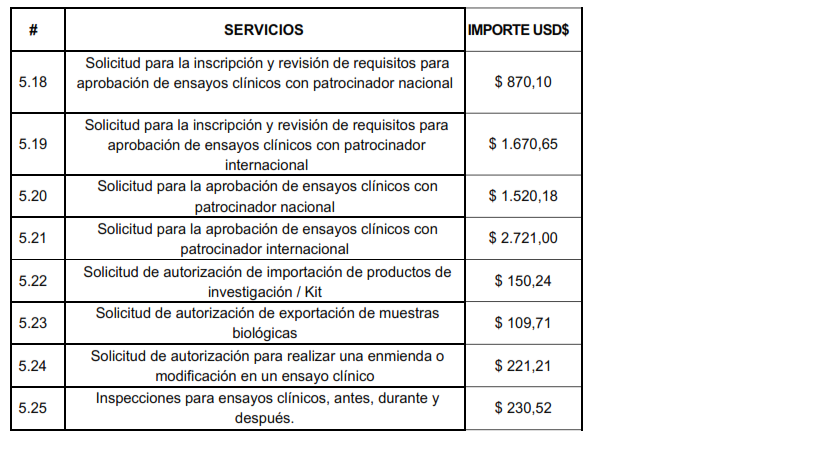
Artículo 5.- Los importes a cobrarse por los servicios, derivados para la aprobación o autorización de Ensayos Clínicos, será los siguientes:
| # | Año-Mes | Volumen de Quejas | Volumen de Atenciones |
|---|---|---|---|
| 1 | 2025-01 | 0 | 2 |
| 2 | 2025-02 | 0 | 2 |
| 3 | 2025-03 | 0 | 0 |
| 4 | 2025-04 | 0 | 1 |
| 5 | 2025-05 | 0 | 2 |
| 6 | 2024-01 | 0 | 0 |
| 7 | 2024-02 | 0 | 0 |
| 8 | 2024-03 | 0 | 0 |
| 9 | 2024-04 | 0 | 0 |
| 10 | 2024-05 | 0 | 0 |
| 11 | 2024-06 | 0 | 4 |
| 12 | 2024-07 | 0 | 1 |
| 13 | 2024-08 | 0 | 3 |
| 14 | 2024-09 | 0 | 3 |
| 15 | 2024-10 | 0 | 0 |
| 16 | 2024-11 | 0 | 2 |
| 17 | 2024-12 | 0 | 0 |
| 18 | 2023-01 | 0 | 0 |
| 19 | 2023-02 | 0 | 0 |
| 20 | 2023-03 | 0 | 5 |
| 21 | 2023-04 | 0 | 1 |
| 22 | 2023-05 | 0 | 0 |
| 23 | 2023-06 | 0 | 1 |
| 24 | 2023-07 | 0 | 0 |
| 25 | 2023-08 | 0 | 2 |
| 26 | 2023-09 | 0 | 0 |
| 27 | 2023-10 | 0 | 0 |
| 28 | 2023-11 | 0 | 0 |
| 29 | 2023-12 | 0 | 0 |
| 30 | 2022-01 | 0 | 2 |
| 31 | 2022-02 | 0 | 1 |
| 32 | 2022-03 | 0 | 0 |
| 33 | 2022-04 | 0 | 1 |
| 34 | 2022-05 | 0 | 0 |
| 35 | 2022-06 | 0 | 0 |
| 36 | 2022-07 | 0 | 0 |
| 37 | 2022-08 | 0 | 1 |
| 38 | 2022-09 | 0 | 0 |
| 39 | 2022-10 | 0 | 0 |
| 40 | 2022-11 | 0 | 3 |
| 41 | 2022-12 | 0 | 0 |
| 42 | 2021-01 | 0 | 4 |
| 43 | 2021-02 | 0 | 0 |
| 44 | 2021-03 | 0 | 0 |
| 45 | 2021-04 | 0 | 2 |
| 46 | 2021-05 | 0 | 0 |
| 47 | 2021-06 | 0 | 7 |
| 48 | 2021-07 | 0 | 0 |
| 49 | 2021-08 | 0 | 0 |
| 50 | 2021-09 | 0 | 2 |
| 51 | 2021-10 | 0 | 0 |
| 52 | 2021-11 | 0 | 3 |
| 53 | 2021-12 | 0 | 2 |
| 54 | 2020-01 | 0 | 1 |
| 55 | 2020-02 | 0 | 4 |
| 56 | 2020-03 | 0 | 0 |
| 57 | 2020-04 | 0 | 0 |
| 58 | 2020-05 | 0 | 0 |
| 59 | 2020-06 | 0 | 0 |
| 60 | 2020-07 | 0 | 0 |
| 61 | 2020-08 | 0 | 0 |
| 62 | 2020-09 | 0 | 1 |
| 63 | 2020-10 | 0 | 1 |
| 64 | 2020-11 | 0 | 1 |
| 65 | 2020-12 | 0 | 1 |
| 66 | 2019-01 | 0 | 3 |
| 67 | 2019-02 | 0 | 1 |
| 68 | 2019-03 | 0 | 1 |
| 69 | 2019-04 | 0 | 0 |
| 70 | 2019-05 | 0 | 2 |
| 71 | 2019-06 | 0 | 0 |
| 72 | 2019-07 | 0 | 0 |
| 73 | 2019-08 | 0 | 0 |
| 74 | 2019-09 | 0 | 0 |
| 75 | 2019-10 | 0 | 2 |
| 76 | 2019-11 | 0 | 2 |
| 77 | 2019-12 | 0 | 5 |
| 78 | 2017-12 | 0 | 2 |
Fecha de última actualización: 2024/12/24