
Trámite orientado para autorizar toda las modificaciones o enmienda que ocurran durante el ensayo clínico. Sólo las enmiendas relacionadas al Protocolo, al Manual del Investigador y al Consentimiento Informado, deberán ser aprobadas previamente por el Comité de Ética de Investigación en Seres Humanos que aprobó el protocolo de investigación.
Enmienda.- descripción escrita del o los cambios al protocolo de investigación, al manual del investigador y/o al consentimiento informado, que no modifique los objetivos, el tiempo de tratamiento y el producto en investigación.
El trámite Solicitud de autorización para realizar una enmienda o modificación en un Ensayo Clínico aplica a toda razón social que cuente con Registro Único de Contribuyente (RUC) de persona natural o jurídica, nacional o extranjera, públicas o privadas.
Dirigido a: Persona Jurídica - Privada, Persona Jurídica - Pública, Persona Natural - Ecuatoriana, Persona Natural - Extranjera.
Autorización de Enmiendas o Modificaciones en un Ensayo Clínico
REQUISITOS PARA AUTORIZACIÓN DE ENMIENDAS
1.- Formato de Solicitud para autorizar una enmienda en un Ensayo Clínico Anexo 1 del INSTRUCTIVO EXTERNO AUTORIZACIÓN DE ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS versión 2.0
2.- Presentar el protocolo; el manual del investigador o el consentimiento informado, resaltando los cambios en relación a la versión aprobada;
3.- La justificación y argumentación técnica de los cambios a realizar.
4.-La Carta de Aprobación de la enmienda por parte del CEISH que aprobó el protocolo del ensayo clínico, cuando la enmienda esté relacionada al Protocolo, al Manual del
Investigador o al Consentimiento Informado, dicha carta deberá detallar los documentos evaluados y aprobados; en casos excepcionales la enmienda podrá ser aprobado por otro CEISH que previamente re-apruebe el ensayo clínico, presentando la debida justificación
5.- Historial de cambios en el desarrollo de la investigación, la tabla debe contener: Versión y fecha del protocolo, Versión y fecha del manual del investigador, versión y fecha del consentimiento informado, descripción breve del cambio, fecha de aprobación por parte del CEISH, Fecha aprobación por la ARCSA
6.- En una tabla se incluirá un Resumen de los cambios realizados en el protocolo, manual del investigador y/o consentimiento informado, para su autorización de la siguiente manera: razón del cambio, Texto previo (protocolo, manual del investigador, consentimiento informado), texto nuevo en protocolo, texto nuevo en manual del investigador, y texto nuevo en consentimiento informado.
7.- Tabla con el resumen de los cambios realizados en el protocolo, folleto del investigador y consentimiento informado, dicha tabla tendrá los siguientes datos: Razón de cambio, Texto previo en protocolo, texto nuevo en protocolo, texto nuevo en manual del investigador, texto en consentimiento informado, indicando (Página citada, # segmento, párrafo)
8.- Demás información que respalde la enmienda
9.- Pago de la Solicitud de autorización para realizar una enmienda en un ensayo clínico.
REQUISITOS PARA AUTORIZACIÓN DE MODIFICACIONES
1.- Solicitud para realizar una modificación en el ensayo clínico previamente aprobado. (Anexo 1INSTRUCTIVO EXTERNO AUTORIZACIÓN DE ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS versión 2.0)
2.- Documentos que justifiquen los cambios de la modificación solicitada.
Tomar en consideración que hasta que no se apruebe una enmienda o modificación, la misma no podrá ser implementada y el estudio deberá seguir su ejecución
según las condiciones con las que fue aprobado, siempre y cuando no implique daños a la salud o vida de los sujetos en investigación.
Presencial
1.-Presentar la respectiva solicitud y requisitos para solicitar la autorización de una enmienda o modificación, mediante oficio en las Coordinaciones Zonales o Planta Central de la Agencia Nacional de Regulación, Control y Vigilancia Sanitaria – ARCSA. (revisar lista de requisitos).
2.- Revisar en el aplicativo Quipux mediante el cual se emitirá la orden de pago de acuerdo a los valores establecidos en Resolución ARCSA-DE-2018-019-JCGO.
3.- Revisar en el aplicativo Quipux si existen observaciones a la Solicitud para autorizar una enmienda o modificación en un Ensayo Clínico, las cuales tendrán que ser resueltas en un plazo de 30 días laborables, contados a partir de recibida la notificación, en caso de no recibir respuesta se cancelará el trámite. Entregar la respuestas a las observaciones mediante oficio en las Coordinaciones Zonales o Planta Central de la ARCSA.
4.- Si una solicitud de modificación o enmienda no fue debidamente justificada, y la ARCSA, a través de la Dirección Técnica de Ensayos Clínicos o quien ejerza sus competencias emite una respuesta negativa por dos (2) ocasiones, el solicitante no podrá realizar más solicitudes de modificación o enmienda sobre dicho cambio.
5.- Revisar en el aplicativo Quipux Si la información presentada está completa y correcta en un término de cuarenta y cinco (45) días, contados a partir de la fecha de presentación de la solicitud, la ARCSA a través de la Dirección Técnica de Ensayos Clínicos o quien ejerza sus competencias proporcionará la respuesta favorable o la respuesta desfavorable.
6.- La Agencia a través de la Dirección Técnica de Ensayos Clínicos podrá realizar inspecciones a los establecimientos cuando exista cualquier solicitud de modificación o enmienda.
Canales de atención: Presencial, Sistema de Gestión Documental Quipux (www.gestiondocumental.gob.ec).
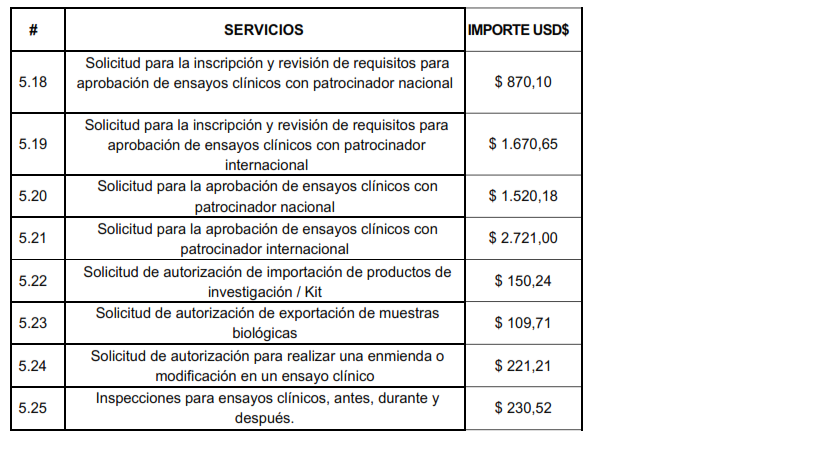
Solicitud de autorización para realizar una enmienda o modificación en un ensayo clínico $221,21
ARCSA Planta Central (Ciudadela Samanes, Av. Francisco de Orellana y Av. Paseo del Parque, Parque Samanes, Bloque 5, Guayaquil - Ecuador). Código Postal: 090703.
De lunes a viernes 08h00 a 16:30.
9 Coordinaciones Zonales https://www.controlsanitario.gob.ec/contacto/
Contacto: Dirección Técnica de Atención al Usuario
Email: atencionalusuario@controlsanitario.gob.ec
Teléfono: 043727440
Art. 13.- Todas las modificaciones que se presenten dentro de un ensayo clínico deberán ser autorizadas por la ARCSA. Aquellas enmiendas relacionadas al Protocolo, al Manual del Investigador y al Consentimiento Informado, deberán ser aprobadas previamente por el Comité de Ética de Investigación en Seres Humanos que aprobó el protocolo de investigación.
Art. 14.- Las solicitudes de modificaciones a ensayos clínicos autorizados, recibirán respuesta favorable o desfavorable de la ARCSA en un término de cuarenta y cinco (45) días, contados a partir de la presentación del trámite. En casos excepcionales, si el patrocinador justifica con documentación de respaldo adecuada que la modificación de ensayo clínico implicará un beneficio para el paciente, el tiempo de análisis de la ARCSA para dicha modificación, será máximo de quince (15) días término.
Art. 15.- La ARCSA no autorizará enmiendas que modifiquen el producto en investigación, el tiempo de tratamiento, ni los objetivos del estudio. En tanto no se apruebe un cambio solicitado, éste no podrá ser implementado y el estudio deberá seguir su ejecución según las condiciones con las que fue autorizado, siempre y cuando no implique daños a la salud o vida de los sujetos
en investigación.
Art. 16.- Para autorizar una enmienda a los documentos del ensayo clínico, la ARCSA analizará al menos lo siguiente:
a) El protocolo, el manual del investigador y el consentimiento informado que incluyan y resalten los cambios, en relación a la versión aprobada.
b) La justificación y argumentación técnica de los cambios realizados.
c) La aprobación de los cambios por parte del Comité de Ética de Investigación en Seres Humanos que aprobó el protocolo del ensayo clínico, cuando corresponda.
Art. 17.- Si la ARCSA requiere aclarar información o completar documentación en un trámite de modificación de un ensayo clínico, el solicitante deberá dar respuesta en el término de treinta (30) días, contados a partir de recibida la notificación en la que se le requiera la presentación de la documentación. En caso de no obtener respuesta se dará por concluido el trámite automáticamente. Si un cambio propuesto no fue debidamente justificado, y la ARCSA emitió una respuesta negativa por dos (2) ocasiones, no se podrán realizar más solicitudes de modificación sobre dicho cambio.
Artículo 5.- Los importes a cobrarse por los servicios, derivados para la aprobación o autorización de Ensayos Clínicos, será los siguientes:
| # | Año-Mes | Volumen de Quejas | Volumen de Atenciones |
|---|---|---|---|
| 1 | 2025-01 | 0 | 0 |
| 2 | 2025-02 | 0 | 0 |
| 3 | 2025-03 | 0 | 0 |
| 4 | 2025-04 | 0 | 0 |
| 5 | 2025-05 | 0 | 0 |
| 6 | 2025-06 | 0 | 0 |
| 7 | 2024-01 | 0 | 0 |
| 8 | 2024-02 | 0 | 1 |
| 9 | 2024-03 | 0 | 0 |
| 10 | 2024-04 | 0 | 0 |
| 11 | 2024-05 | 0 | 0 |
| 12 | 2024-06 | 0 | 0 |
| 13 | 2024-07 | 0 | 0 |
| 14 | 2024-08 | 0 | 1 |
| 15 | 2024-09 | 0 | 1 |
| 16 | 2024-10 | 0 | 0 |
| 17 | 2024-11 | 0 | 0 |
| 18 | 2024-12 | 0 | 0 |
| 19 | 2023-01 | 0 | 0 |
| 20 | 2023-02 | 0 | 0 |
| 21 | 2023-03 | 0 | 0 |
| 22 | 2023-04 | 0 | 0 |
| 23 | 2023-05 | 0 | 0 |
| 24 | 2023-06 | 0 | 0 |
| 25 | 2023-07 | 0 | 0 |
| 26 | 2023-08 | 0 | 0 |
| 27 | 2023-09 | 0 | 0 |
| 28 | 2023-10 | 0 | 1 |
| 29 | 2023-11 | 0 | 0 |
| 30 | 2023-12 | 0 | 0 |
| 31 | 2022-01 | 0 | 0 |
| 32 | 2022-02 | 0 | 0 |
| 33 | 2022-03 | 0 | 0 |
| 34 | 2022-04 | 0 | 0 |
| 35 | 2022-05 | 0 | 0 |
| 36 | 2022-06 | 0 | 0 |
| 37 | 2022-07 | 0 | 0 |
| 38 | 2022-08 | 0 | 0 |
| 39 | 2022-09 | 0 | 0 |
| 40 | 2022-10 | 0 | 0 |
| 41 | 2022-11 | 0 | 0 |
| 42 | 2022-12 | 0 | 0 |
| 43 | 2021-01 | 0 | 2 |
| 44 | 2021-02 | 0 | 1 |
| 45 | 2021-03 | 0 | 3 |
| 46 | 2021-04 | 0 | 0 |
| 47 | 2021-05 | 0 | 3 |
| 48 | 2021-06 | 0 | 0 |
| 49 | 2021-07 | 0 | 0 |
| 50 | 2021-08 | 0 | 1 |
| 51 | 2021-09 | 0 | 0 |
| 52 | 2021-10 | 0 | 0 |
| 53 | 2021-11 | 0 | 0 |
| 54 | 2021-12 | 0 | 0 |
| 55 | 2020-01 | 0 | 0 |
| 56 | 2020-02 | 0 | 4 |
| 57 | 2020-03 | 0 | 0 |
| 58 | 2020-04 | 0 | 0 |
| 59 | 2020-05 | 0 | 1 |
| 60 | 2020-06 | 0 | 0 |
| 61 | 2020-07 | 0 | 0 |
| 62 | 2020-08 | 0 | 0 |
| 63 | 2020-09 | 0 | 0 |
| 64 | 2020-10 | 0 | 1 |
| 65 | 2020-11 | 0 | 0 |
| 66 | 2020-12 | 0 | 1 |
| 67 | 2019-01 | 0 | 1 |
| 68 | 2019-02 | 0 | 1 |
| 69 | 2019-03 | 0 | 0 |
| 70 | 2019-04 | 0 | 0 |
| 71 | 2019-05 | 0 | 0 |
| 72 | 2019-06 | 0 | 0 |
| 73 | 2019-07 | 0 | 0 |
| 74 | 2019-08 | 0 | 0 |
| 75 | 2019-09 | 0 | 4 |
| 76 | 2019-10 | 0 | 4 |
| 77 | 2019-11 | 0 | 0 |
| 78 | 2019-12 | 0 | 0 |
| 79 | 2017-12 | 0 | 8 |
Fecha de última actualización: 2023/08/22